- Интернет-магазин
- Медицинский центр
- Обучение
Статьи о лечении и уходе за волосамиБиология волос
Жизнь волос на всех этапах находится под контролем гормонов (от греч.«возбуждать, приводить в движение»), так что вовсе не случайно то, что волосы чувствительны практически к любым нейроэндокринным нарушениям. Лечение волос не даст положительного эффекта, если гормональный фактор не будет учтен. Именно поэтому мы решили посвятить отдельную главу нейроэндокринной регуляции волос.
Авторы:
- Ткачев В.П. Кандидат мед. наук. Врач-эндокринолог, трихолог. Руководитель курса медицинской трихологии при ФПК МР РУДН г. Москва.
- Шарова А.А. Кандидат мед. наук. Врач-дерматовенеролог, косметолог, трихолог. Доцент кафедры реконструктивной и пластической хирургии РНИМУ им. Н.И. Пирогова.
Жизнь волос на всех этапах находится под контролем гормонов (от греч.«возбуждать, приводить в движение»), так что вовсе не случайно то, что волосы чувствительны практически к любым нейроэндокринным нарушениям. Лечение волос не даст положительного эффекта, если гормональный фактор не будет учтен. Именно поэтому мы решили посвятить отдельную главу нейроэндокринной регуляции волос.
2.1. Половые гормоны
Важной вехой в учении о влиянии гормонов на функции организма стал доклад Шарля Броун-Секара в мае 1889 г. Он сообщил Парижской академии наук о результатах опытов, которые произвел над собой. С целью борьбы со старостью (ему было уже за семьдесят) ученый разрушал яички морской свинки, а экстракт вводил себе под кожу живота. К счастью для исследователя, эксперимент завершился успешно, и теперь во всех отношениях он чувствовал себя омоложенным.
Вряд ли идея введения омолаживающего коктейля пришла бы в голову Броун-Секара, если бы этому не предшествовал тысячелетний опыт человечества, показывающий, какие последствия для человека и животных влечет за собой кастрация и другие вмешательства на гормонально-активных органах.
Еще за 40 лет до Броун-Секара Арнольд Бертольд экспериментировал с петухами, удаляя и подсаживая им яички. Тем птицам, которым он вновь подсаживал удаленные органы, удалось оставаться здоровыми петухами, у остальных же сморщивался гребень, угасал половой инстинкт, исчезала драчливость, яркое и пестрое оперение сменялось тусклым, начиналось отложение жира. Эксперимент доказал, что нормальную жизнедеятельность яички регулируют не только и не столько через иннервацию, как ранее предполагали. Ведь при операции связь между яичками и их нервами была нарушена. Главная роль, по мнению наблюдательного ученого, отводилась «воздействию яичка на кровь, а затем и соответствующему воздействию на весь организм в целом».
Аристотель (384–392 гг. до н.э.) отмечал, что «…из всех животных лысеет только человек, потому что он имеет наибольший и наиболее влажный мозг. Женщины не лысеют, так как по своей природе они сходны с детьми: и те, и другие не производят выделения семени. И евнух не становится лысым, так как он превращается в женщину, причем волосы, появляющиеся позднее, или не вырастают у него совсем, или, если имеются, выпадают, за исключением волос на лобке: ведь и женщины упомянутых волос не имеют, а волосы на лобке уних растут».
Интересно, что Аристотель обратил внимание на один из парадоксов с позиций современной эндокринологии. Ведь волосяной фолликул — единственный «орган», который по-разному отвечает на один и тот же гормон (ныне известно, что это — дигидротестостерон) в зависимости от своей локализации. Андрогены, стимулирующие рост волос в таких областях, как усы и борода, грудь и живот, нередко подавляют фолликулы волос на скальпе, вызывая облысение. Эстрогены же, напротив, обеспечивают рост волос на волосистой части головы, но не в «зонах полового оволосения».
В 1935 г. Эрнст Лако выделяет из тестикул быка «кристаллический мужской гормон», в этом же году немецкий химик Адольф Бутенандт получает и описывает структуру тестостерона, а неделей позже Леопольд Ружичка, югославский химик, сообщает о методе синтеза тестостерона из холестерина. «Новая» история применения андрогенов развивается стремительно и громко. Всего через четыре года после открытия тестостерона, в 1939 г., Ружичка и Бутенандт получают Нобелевскую премию за открытие метода синтеза тестостерона из холестерина.
Сегодня биосинтез стероидных гормонов (стероидогенные пути) известен в деталях (рис. I-2-1), хотя все еще остаются «белые пятна».
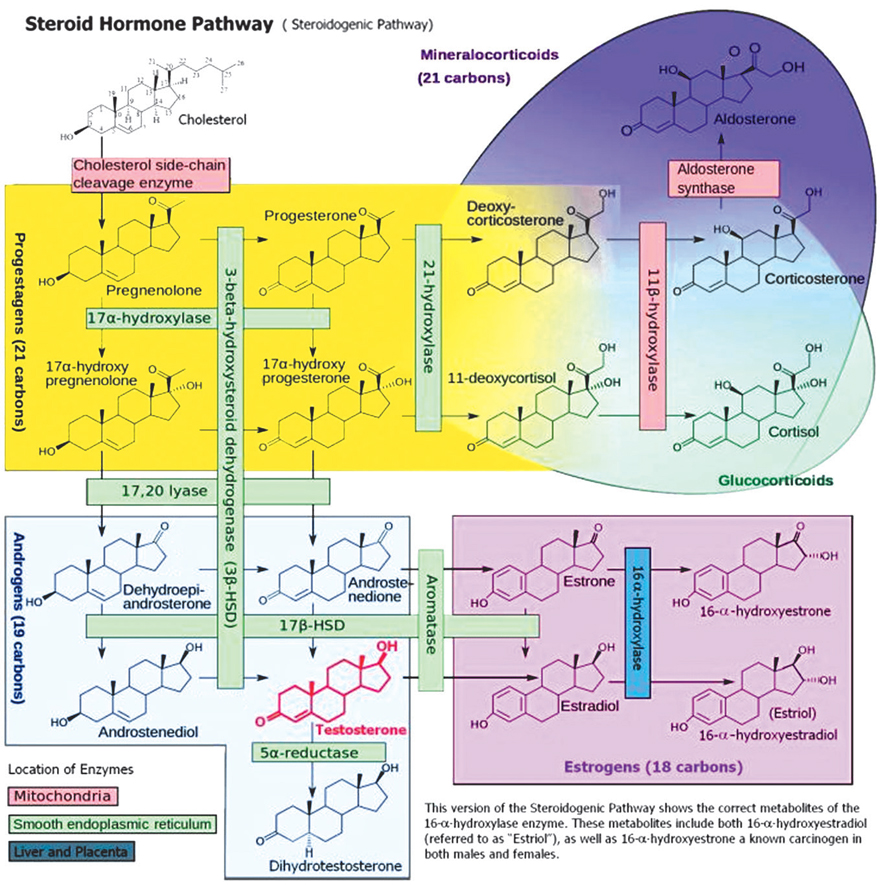
Рис. I-2-1. Биосинтез стероидных гормонов в организме человека2.1.1. Андрогены
Тестостерон и дигидротестостерон. Известно, что тестостерон является основным андрогеном у мужчин. Главный источник тестостерона — клетки Лейдига — расположены в яичках, где секретируется до 95% (чуть менее 10 мг) этого гормона. Лишь 5% тестостерона образуется путем периферической конверсии предшественников в надпочечниках. У женщин секретируются те же гормоны, что и у мужчин, и однако их соотношение у разных полов отличается. Уровень секреции тестостерона у женщин, вырабатываемого яичниками и надпочечниками, в 10–20 раз ниже, чем у мужчин (рис. I-2-2).
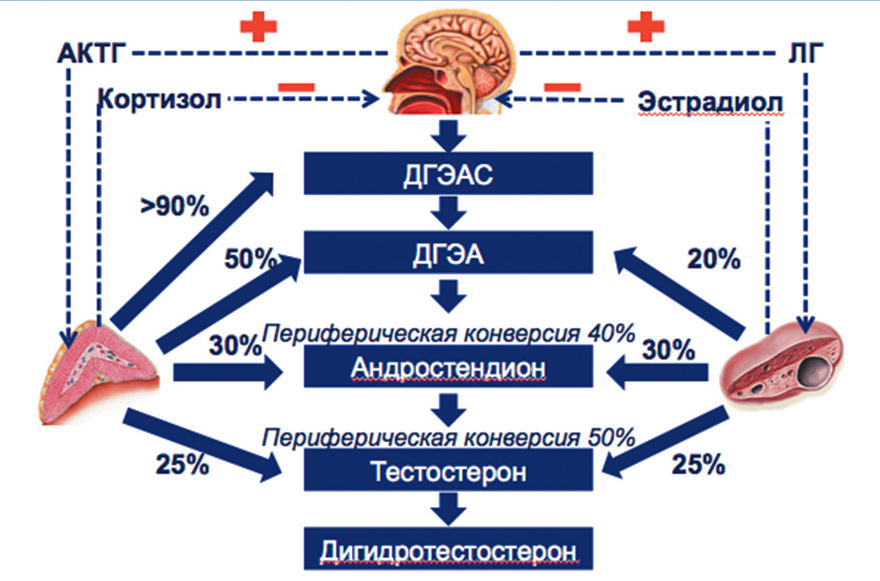
Рис. I-2-2. Источники андрогенов и их периферическая конверсия у женщин репродуктивного возрастаСывороточный тестостерон связывается глобулином, объединяющим половые гормоны, и в меньшей степени — с альбумином. 1–2% общей фракции остается в свободной форме, способной проникать в клетки и под влиянием 5α-редуктазы трансформироваться в дигидротестостерон (ДГТ).
Известны три изоформы 5α-редуктазы. В волосяных фолликулах вырабатывается преимущественно 2-й тип, пятикратно увеличивая андрогенную активность тестостерона на данном участке. У пациентов, имеющих дефицит 5α-редуктазы, не растут волосы на теле и не развивается андрогенетическая алопеция. Биопсия кожи головы лобных и затылочных областей головы показала, что лысеющие мужчины и женщины имеют более высокие уровни обоих типов 5α-редуктазы в фолликулах лобной зоны в сравнении с фолликулами из затылочной зоны.
По данным Sawaya и Price (1997), концентрация 5α-редуктазы 1-го и 2-го типов у женщин меньше, чем у мужчин, в 3 и 3,5 раза соответственно. Неудивительно, что применение финастерида — мощного блокатора 5α-редуктазы 2-го типа — имеет доказанный положительный эффект при лечении андрогенетической алопеции у мужчин и в меньшей степени — у женщин.
Как у мужчин, так и у женщин кожа (сосочковый слой дермы) и волосяные фолликулы сами вырабатывают тестостерон (паракринный синтез), а также обеспечивают его трансформацию в ДГТ.
Вызывают интерес публикации, показывающие положительное влияние на рост волос на голове местной терапии тестостероном. Так, в эксперименте Christopher с соавт. (1965) описаны положительные результаты наружного применения тестостерона при облысении у мужчин. Мужчины с андрогенетической алопецией (21 человек) ежедневно наносили крем с тестостерона пропионатом в области облысения. У 75% участников этого исследования было отмечено улучшение роста волос в зоне обработки.
Таким образом, не сам тестостерон, а именно активность 5α-редуктазы и накопление ДГТ являются факторами, вызывающими облысение. Системный андрогенный дефицит не является какой-либо гарантией отсутствия алопеции по мужскому типу. Из практики известно, что даже самое тщательное исследование сывороточного тестостерона не позволяет четко понять особенности его периферического синтеза, конверсии и взаимодействия метаболитов с рецепторами органов-мишеней, в том числе фолликулов волос в каждом случае.
В связи с этим обстоятельством, согласно Международному руководству по диагностике и лечению андрогенетической алопеции у мужчин и женщин (Evidence based (S3) guidelines for the treatment of androgenetic alopecia in woman and in men), с целью диагностики андрогенетической алопеции не рекомендуется исследовать тестостерон как мужчинам, так и женщинам, за исключением случаев, когда имеются другие признаки избытка андрогенов. Автор (Ткачев В.П.) неоднократно наблюдал наличие андрогенной алопеции как у мужчин, так и у женщин при дефиците тестостерона, нормальном его уровне или при избытке.
Фермент цитохром P450-ароматаза (ароматаза) имеет функции, противоположные 5α-редуктазе. Благодаря этому ферменту, тестостерон конвертируется в эстрадиол, а андростендион — в эстрон. Примечательно, что концентрация ароматазы в лобно-теменной зоне у женщин в 6 раз выше, чем у мужчин, что, по-видимому, и позволяет женщинам сохранять волосы в лучшем состоянии (Sawaya M.E., Orice V.H., 1997).
В настоящее время уточняется роль дефицита ароматазы, особенно в развитии женской андрогенетической алопеции (female pattern hair loss, FPHL). Известно, что при лечении карциномы молочной железы блокаторами ароматазы у многих женщин развивается алопеция.
Интересно, что FPHL может развиваться и при отсутствии значимых уровней андрогенов. Такие факты, как развитие облысения у женщин при гипогонадотропном гипогонадизме, дебют андрогенетической алопеции еще до развития пубертатного возраста, слабый ответ на лечение системными антиандрогенами (с применением ципротерона ацетата) и финастерид свидетельствуют, что выпадение волос у женщин в меньшей степени зависит от активности андрогенов.
Еще более интересными являются сообщения о том, что лечение тестостероном женщин так же, как и мужчин, в ряде случаев способствует улучшению роста волос на волосистой части головы. Так, исследование, проведенное Glaser с соавт. (2012) показало, что среди андроген-дефицитных женщин 76 из 285 пациенток (27%) жаловались на истончение волос. 48 из них (63%) отметили улучшение в состоянии волос на фоне терапии тестостероном.
Среди тех, кто не отметил улучшения, преобладали женщины с повышенным индексом массы тела (ниже мы обсудим роль висцерального ожирения, метаболического синдрома и инсулинорезистентности в развитии алопеций, см. ч. I, п. 2.5). Таким образом, поиск других причинных факторов женского типа потери волос (FPHL), не связанных с андрогенами, актуален.
Дигидроэпиандростерон. Еще один андроген, дигидроэпиандростерон (ДГЭА) в организме синтезируется надпочечниками. Будучи веществом стероидной природы, он выступает субстратом для синтеза эстрогенов и андрогенов, хотя и сам обладает слабыми андрогенными свойствами.
О положительном влиянии ДГАЭ на кожу и ее придатки говорится во многих публикациях. В частности, этот гормон предотвращает фотоповреждение и стимулирует процессы заживления кожи. Возможно, эти эффекты связаны в том числе со способностью ДГАЭ повышать синтез проколлагена и угнетать деградацию коллагена.
В коже имеются ферменты для конверсии циркулирующего ДГЭА и его сульфатированной формы (ДГЭА-сульфата) в активные андрогены и эстрогены. Вероятнее всего, положительное действие на кожу опосредовано образующимися в результате ароматизации ДГЭА эстрогенами. Исследования in vitro свидетельствуют о существовании прямого ингибирующего влияния ДГЭА на экспрессию провоспалительных цитокинов ИЛ-6, ингибитора миграции макрофагов (МИФ) и фактора некроза опухоли макрофагами кожи (Labrie F., et al., 1998).
Начиная с 30-летнего возраста, секреция ДГЭА надпочечниками стремительно снижается, составляя к 60 годам всего лишь 50% максимального уровня. Ряд врачей, занимающихся медициной anti-age, придерживаются точки зрения о необходимости проведения заместительной терапии этим гормоном при его возрастном дефиците точно так же, как это принято при дефиците эстрогенов, тестостерона, тироксина и других гормонов.
Рецепторы к андрогенам. Важная роль в потере волос принадлежит рецепторам к андрогенам. Сродство рецепторов к андрогенам к ДГТ в 5–6 раз выше, чем к тестостерону. При этом данные рецепторы имеют низкое сродство к ДГЭА. Оценка количества рецепторов к андрогенам в области фронтальной линии роста волос показала, что у женщин их примерно на 40% меньше, чем у мужчин (Sawaya M.E., Price V.H., 1997).
Продукция рецепторов к андрогенам регулируется геном Хq11-q12, локализованным на длинном плече Х-хромосомы. Связь гена Хq11-q12 с облысением показана на примере болезни Кеннеди (Sinclair R., Greenland K.J., 2007). При этом заболевании сочетаются тестикулярная атрофия, низкая вирилизация и прогрессирующая спинальная мышечная атрофия. У 115 пациентов с болезнью Кеннеди выраженность облысения была существенно ниже в сравнении с группой контроля.
Более высокий уровень рецепторов к андрогенам выявлен в тех зонах, где облысение развивается наиболее часто. В настоящее время развивается технология генетического тестирования для определения риска облысения. Исследование Prodi D.A. с соавт. (2008), включавшее когорту из 200 мужчин с выраженной андрогенетической алопецией и с ранним ее развитием в возрасте до 30 лет, показало очевидную связь алопеции с генами Xq11-q12 и EDA2R.
Другое исследование, проведенное в Германии и включившее 391 человека, позволило определить участие еще одного гена в развитии андрогенетической алопеции — 3q26. Крупное популяционное исследование 1125 мужчин из Швейцарии, Великобритании, Нидерландов, Исландии продемонстрировало связь андрогенетической алопеции с локусом хромосомы 20р11.22 (Richards J.B. с соавт., 2008).
При женском типе андрогенетической алопеции очевидной связи между полиморфизмом рецепторов к андрогенам не выявлено (El-Samahy M.H., Shaheen M.A., Saddik D.E.,2009).
2.1.2. Эстрогены
Эстрадиол. Эстрадиол (17β-эстрадиол) представляет собой половой гормон из семейства эстрогеновых. По химическому строению эстрадиол является стероидом. Помимо эстрадиола, к эстрогеновым гормонам относят еще два вещества — это эстрон и эстриол. Однако именно за счет эстрадиола реализуются основные физиологические эффекты эстрогеновых гормонов. Данный гормон относится к типично женским, поскольку вырабатывается в организме женщин в относительно больших количествах.
Эстрадиол создает женский фенотип и абсолютно необходим для овуляции. Для синтеза эстрадиола требуется холестерин — он превращается в тестостерон, часть которого в свою очередь соединяется с ацетил-КоА, вследствие чего образуется прогестерон. Далее из имеющихся запасов прогестерона и тестостерона в оболочке растущего фолликула яичников образуется эстрадиол.
Во время первой фазы менструального цикла почти весь прогестерон превращается в эстрадиол, который обеспечивает рост и созревание яйцеклетки. Затем, после овуляции, яичники начинают вырабатывать большое количество прогестерона. Из-за относительно низкой скорости превращения прогестерона в эстрадиол во второй фазе менструального цикла у женщин превалирует именно прогестерон над всеми остальными гормонами, что обусловливает соответствующие эффекты. Колеблясь от 40 пг/мл в первую фазу менструального цикла, концентрация эстрадиола достигает 450 пг/мл к овуляторному пику. К менопаузе секреция эстрадиола снижается до 20 пг/мл.
Контроль выработки эстрадиола осуществляется фолликулостимулирующим гормоном (ФСГ), лютеинизирующим гормоном (ЛГ) и пролактином, а в период беременности — хорионическим гонадотропином (ХГЧ). Небольшие количества эстрадиола вырабатываются также корой надпочечников у обоих полов и яичками у мужчин. У мужчин основным источником эстрадиола является конверсия (ароматизация) андрогенов (тестостерона и андростендиона) в эстрогены в периферических тканях, происходящая при участии фермента P450-ароматазы.
У женщин аутокринный синтез эстрогенов в периферических тканях приближается к 100% после наступления менопаузы, не считая небольшого количества, синтезируемого из овариального и/или надпочечникового тестостерона и андростендиона. Таким образом, у постменопаузальных женщин практически все активные половые стероиды производятся в тканях-мишенях по аутокринному механизму.
Эстрадиол вызывает пролиферацию эндометрия, повышает содержание коллагена, гидратацию и эластичность кожи, ее тургор, способствует заживлению ран. К эстрогенам чувствительны не только собственно кожа, но и ее придатки — волосяные фолликулы (Thornton M.J, 2005). Например, эстрадиол удлиняет анагеновую фазу (Hoffman R., 2004).
Ряд клинических наблюдений — улучшение роста волос при беременностии ухудшение в менопаузу, индукция алопеции блокаторами ароматазы,положительный опыт топического применения эстрогенов в области волосистой части головы — не оставляют сомнений в благоприятном влиянии эстрогенов на регуляцию роста волос. Исследования показывают, что β-рецепторы эстрогенов присутствуют в волосяных фолликулах человека со специфическими для каждого пола различиями.
В то же время было показано, что один из стереоизомеров — 17α-эстрадиол (альфатрадиол) — не эффективен при наружном применении для лечения андрогенетической алопеции у женщин (Blume-Peytavi U., et al., 2007).
Прогестерон. Прогестерон — стероидный гормон, производимый у женщин в яичниках и в плаценте при беременности, а у мужчин — яичками. Небольшое количество гормона у обоих полов выделяют надпочечники. Прогестерон понижает возбудимость маточных мышц, в то же время повышает тонус шейки матки и самой матки. Благоприятствует переходу в секреторную фазу слизистой оболочки тела матки, скоплению в ней гликогена, что служит благоприятным фактором для развития плода. Прогестерон способствует формированию женского телосложения, влияет на рост волос, развитие половых органов, груди, подготавливает организм к деторождению, грудному вскармливанию.
Прогестерон является предшественником ряда нейростероидов в головном мозге. В частности, он является предшественником аллопрегненолона, оказывающего воздействие на рецепторы ГАМК. Таким образом, прогестерон в значительной степени «модулирует» настроение, обеспечивая чувство покоя и релаксации.
Топическая терапия прогестероном достоверно ингибирует 5α-редуктазу в исследовании in vitro. По данным Cassidenti D.L. с соавт. (1991), в высоких концентрациях прогестерон ингибировал синтез ДГТ на 97%, эстрадиол — на 41%, в то время как медроксипрогестерона ацетат и этинилэстрадиол значимого эффекта не показали.
2.2. Тиреоидные гормоны и ТТГ
Волосяной фолликул крайне чувствителен к тиреоидным гормонам, и выпадение волос наблюдается и при гипо-, и гипертиреозе.
Тиреоидные гормоны. Тиреоидные гормоны тироксин (Т4) и трийодтиронин (Т3) синтезируются и секретируются клетками фолликулярного эпителия щитовидной железы и содержат в своем составе йод. Щитовидная железа секретирует в 10 раз больше Т4, чем Т3. Около 40% Т4 впоследствии метаболизируется до Т3. Большая часть Т4 и Т3 циркулируют в связанном с белками плазмы состоянии. В клетках-мишенях тиреоидные гормоны связываются со специфическими ядерными рецепторами, стимулируя синтез белков. В клетках волосяных фолликулов обнаружены ядерные рецепторы тироксина TRβ1. Показано, что тироксин повышает выживаемость клеток волосяных фолликулов (Bordo E., et al., 2009).
Патология щитовидной железы часто упоминается в качестве причины потери волос. По данным Балаболкина М.Е. (2007), изменение структуры волос, их сухость и ломкость наблюдаются у 84–91% пациентов с гипотиреозом, а клинически значимая потеря волос — у 34%. У каждого четвертого пациента с гипофункцией щитовидной железы отмечается поредение наружных углов бровей. Интересно, что при повышенной функции щитовидной железы, помимо потери волос на голове, часто страдают волосы в подмышечной зоне.
Регулирование секреции Т3 и Т4 осуществляет тиреотропный гормон (ТТГ, тиреотропин) гипофиза, а секрецию последнего стимулирует тиреотропин-рилизинг гормон (ТРГ, тиреолиберин) гипоталамуса. По механизму обратной связи тиреоидные гормоны подавляют секрецию как ТТГ, так и ТРГ.
Тиреотропный гормон (ТТГ). ТТГ, воздействуя на специфические рецепторы в щитовидной железе, стимулирует выработку и активацию тироксина. Стимуляция рецепторов ТТГ в органной культуре изменяет экспрессию множества генов (например, кератина К5) в клетках волосяных фолликулов скальпа. Хотя функциональная роль ТТГ в биологии человеческих волосяных фолликулов еще только начинает изучаться, получены данные, свидетельствующие, что волосяные фолликулы у женщин являются мишенями для прямого экстратиреоидного действия ТТГ.
Экспрессия функционально активных рецепторов ТТГ в коже может иметь важные физиологические и патологические последствия, особенно в условиях аутоиммунитета, достаточно четко прослеживается связь между аутоиммунным тиреоидитом и гнездной алопецией.
Истончение волос при гипотиреозе происходит неравномерно. Часть волос истончается значимо, часть волос реагирует незначительно (бимодальное распределение). Такой же тип истончения стержней волос характерен для андрогенетической алопеции. У исследователей возникает вопрос, не является ли именно андрогенетическая алопеция предпосылкой для развития алопеции при гипотиреозе (Trueb R.M., 2010).
Обращает внимание тот факт, что терапия эстрогенами, в том числе комбинированными оральными контрацептивами, повышает концентрацию глобулина, связывающего тироксин, что может приводить к гипотиреозу. Важно помнить о том, что особого внимания требуют пациенты с повышенным риском поражения щитовидной железы на фоне терапии йодидами, тиреостатиками, амиодароном, препаратами лития, интерферонами, а также носители повышенных титров антител к тироидной пероксидазе, особенно при повышении уровней ТТГ в сыворотке крови более 2,0 мМЕ/л. По результатам популяционного Викгемского исследования, такой уровень ТТГ сопровождается повышенным риском гипотиреоза в будущем (Vanderpump M.P., et al., 1995).
2.3. Пролактин
Пролактин входит в семейство близких по строению гормонов, к которому относятся также гормон роста и плацентарный лактоген. Предполагается, что все они произошли от общего гена-предка около 500 млн лет назад. К настоящему времени описано более 300 различных функций пролактина, что свидетельствует о чрезвычайной важности этого гормона в поддержании гомеостаза организма (Harris J., 2004).
В методическом пособии для врачей под редакцией Мельниченко Г.А. приведены следующие сведения. Гиперпролактинемия — это повышение уровня пролактина сыворотки крови. Она является наиболее частым биохимическим маркером гипоталамо-гипофизарной дисфункции, с которой сталкиваются в клинической практике эндокринологи. Хотя пролактиномы представляют около 40% всех новообразований гипофиза, не только они являются причиной гиперпролактинемии.
Повышенная секреция пролактина может наблюдаться при различных клинических и физиологических состояниях, во время приема некоторых лекарственных препаратов. Так, при беременности и лактации, после манипуляций на молочной железе, при гипотиреозе, стрессовых ситуациях, физических нагрузках, голодании, при приеме нейролептиков, антидепрессантов, эстрогенов, на фоне употребления большого количества пива, после оргазма уровень пролактина функционально повышается до 27–200 нг/мл. Синдром гиперпролактинемии — это сочетание гиперпролактинемии и нарушений менструального цикла, бесплодия, галактореи у женщин, снижения либидо и потенции у мужчин. Данный синдром также носит название гиперпролактинемического гипогонадизма и у женщин — синдрома персистирующей галактореи-аменореи.
Дерматологи нередко встречаются с кожными проявлениями избытка пролактина — себореей, акне, гирсутизмом, выпадением волос. Рецепторы пролактина достаточно широко экспрессируются в коже (Ouhtit A., 1993), преимущественно клетками волосяных фолликулов.
Установлено, что пролактин обладает мультифункциональным, цитокиноподобным и нейромедиаторным эффектами на различные функции клеток кожи. Связываясь со своими специфическими рецепторами в коже, модулируя высвобождение цитокинов и факторов роста мезенхимальными клетками, пролактин осуществляет свое регулирующее действие на иммунную систему кожи и пролиферацию эпителия (Slominski A., Wortsman J., 2000). Важной функцией пролактина в коже является его действие как иммуномодулирующего агента стрессового ответа (Clevenger C.V., 1998; Arck P.C., 2006).
Пролактин вовлечен в патогенез таких заболеваний, как псориаз, алопеция, стресс-индуцированные дерматозы (Paus R., et al., 1991; Foitzik K., et al., 2008). О возможной вовлеченности ПРЛ в патогенез псориаза косвенно свидетельствует и тот факт, что назначение бромокриптина (агониста дофамина, который угнетает секрецию пролактина гипофизом) пациенткам с псориазом и пролактиномой не только снижал уровень ПРЛ в крови, но и приводил к явному клиническому улучшению течения псориаза (Sánchez Regaña M., et al., 2000).
Пролактин оказывает значимое влияние и на пилосебацейный комплекс, о чем свидетельствует развитие гирсутизма и себореи при гиперпролактинемии у женщин. В основном эффекты пролактина опосредованы стимуляцией продукции андрогенов надпочечниками (Glickman S.P., et al., 1982). Однако Wielgosz и Armstrong еще в 1977 г. продемонстрировали достоверное увеличение массы сальных желез под действием пролактина у крыс, доказав тем самым его прямое себотропное действие. Влияние пролактина на сальные железы подтверждает и то, что в ряде случаев угревая болезнь ассоциируется с идиопатической гиперпролактинемией в отсутствие каких бы то ни было нарушений андрогенового статуса (Fitzpatrick T.B., et al., 1993; Foitzik K., et al., 2005).
Роль пролактина в регуляции цикла роста волос у человека до конца не ясна. Гиперпролактинемия, помимо характерных для этого состояния аменореи и бесплодия, в ряде случаев опровождается появлением вульгарных угрей, гирсутизмом и усиленным выпадением волос, сходным по характеру с андроген-зависимой алопецией. Это может быть связано с тем, что пролактин способен повышать синтез андрогенов, хотя, как было показано in vivo и in vitro, он одновременно снижает активность 5α-редуктазы (Serafini P., Lobo R.A., 1986). Тем не менее имеются данные, что у мужчин с ранним облысением (до 30 лет) нередко обнаруживаются субнормальные уровни сывороточного пролактина (Starka L., et al., 2004), а у женщин телогеновое выпадение волос может быть проявлением побочного действия бромокриптина — дофаминергического ингибитора гипофизарной секреции пролактина (Sinclair R.D., et al., 1999). Наконец, гиперпролактинемия нередко ассоциирована с потерей волос по андрогенетическому типу и гирсутизмом у женщин (Schmidt J.B., et al., 1991; Schmidt J.B., 1994).
С другой стороны, нельзя исключить, что наблюдаемые эффекты пролактина на волосяные фолликулы осуществляются отчасти и непрямым путем, например через уже установленное действие пролактина на метаболизм периферических андрогенов. Обычно волосяные фолликулы затылочной зоны не чувствительны к действию таких гормонов, как андрогены. Но пролактин способен индуцировать катаген даже в этой гормон-независимой зоне скальпа.
Инкубация органной культуры человеческих волосяных фолликулов в условиях высокой концентрации пролактина в среде (400 нг/мл) приводит к отчетливому угнетению роста волос и стимуляции преждевременного вхождения волосяных фолликулов в фазу катагена, что сопровождается снижением пролиферации и увеличением апоптоза кератиноцитов волосяной луковицы (Foitzik K., et al., 2005). Эти данные проливают свет на механизмы развития алопеции при синдроме гиперпролактинемии у больных с пролактиномой.
Волосяные фолликулы не только экспрессируют функциональные рецепторы пролактина, но и сам гормон. Учитывая, что в среднем на теле человека находится около 5 млн волосяных фолликулов, суммарно они могут быть значимым источником пролактина.
Предполагается, что имеются и обратные сигналы от клеток кожи, которые модифицируют высвобождение пролактина гипофизом. В результате формируется замкнутая саморегулирующаяся система между центральной нервной системой и кожей. Но чтобы в этом убедиться наверняка, требуется дальнейшее изучение роли пролактина в биологии кожи, например при сравнении его действия в здоровой и в патологически измененной коже; сравнение доли пролактина в системном кровотоке, выделяемого волосяными фолликулами и гипофизом.
2.4. Гормоны гипоталамо-гипофизарно-надпочечниковой системы
Гипоталамо-гипофизарно-надпочечниковая система представляет собой сеть гормональной регуляции, активация которой происходит в ответ на стресс. Стресс может принимать самые разнообразные формы, включая такие критические ситуации, как представляющие угрозу для жизни заболевания, хирургические вмешательства и кровотечения, а также хронические воздействия стрессовых факторов, как в случае депрессии или нарушений функции системы пищеварения.
Активное выпадение волос часто наблюдается после перенесенного стресса, и это обстоятельство однозначно свидетельствует о чувствительности волосяных фолликулов к гормонам, запускающим и регулирующим стрессовую реакцию организма.
Кожа является стратегическим барьером между внутренней и внешней средой, поэтому она постоянно подвергается воздействию негативных стрессовых факторов. Чтобы противостоять их агрессивному воздействию, кожа располагает высокоорганизованной системой, интегрирующей кортикотропин-рилизинг-гормон (КТ-РГ) и белки семейства проопиомеланокортина (ПОМК), главным образом — адренокортикотропный гормон (АКТГ) и α-меланоцитстимулирующий гормон (α-МСГ). Органные культуры человеческих волосяных фолликулов также демонстрируют синтез кортизола, его секрецию и негативную обратную регуляцию с КТ-РГ.
По сути, эта система представляет собой аналог гипоталамо-гипофизарно-надпочечниковой оси — главной антистрессорной системы кожи. Ее активация стрессовыми факторами, в частности, ультрафиолетовым (УФ) излучением и провоспалительными цитокинами, начинается с продукции и высвобождения КТ-РГ клетками кожи. В коже КТ-РГ действует как провоспалительный медиатор, вызывая дегрануляцию тучных клеток и повышая проницаемость сосудов.
Помимо этого, он угнетает пролиферацию и модулирует экспрессию факторов воспаления в клетках эпидермиса. Получены данные, свидетельствующие и о возможности противовоспалительного действия КТ-РГ. Например, при термических ожогах локальные инъекции КТ-РГ оказывают противоотечное действие, КТ-РГ обладает антиноцицептивной активностью и ускоряет заживление кожи. КТ-РГ обладает разносторонним действием и на волосяные фолликулы, модулируя важнейшие их характеристики: удлинение стержня волоса, индукцию катагена, пролиферацию кератиноцитов волоса, продукцию меланина. Интересно, что кожа и волосяные фолликулы обладают и системой обратной связи Например, гидрокортизон угнетает экспрессию КТ-РГ в волосяных фолликулах, а дексаметазон оказывает аналогичное действие на меланоциты (Ito N., et al., 2005; Slominski A., Wortsman J., 2000).
Белки-производные ПОМК оказывают свое действие, связываясь с так называемыми меланокортиновыми рецепторами. Меланокортиновые рецепторы (рецепторы МК) обнаружены в сальных, потовых эккриновых железах, волосяных фолликулах и эпидермисе кожи человека и крыс.
α-МСГ влияет на дифференцировку кератиноцитов, изменяет их иммунные функции и регулируют активность дермальных фибробластов, угнетает экспрессию белка теплового шока, что подтверждает гипотезу о роли МСГ в гомеостазе, выживаемости и цитопротекции (Orel L., et al., 1997). Кроме того, этот гормон стимулирует продукцию и высвобождение молекул женских сексуально привлекательных запахов и мужских феромонов, провоцирующих агрессию у животных (Thody A.J., Graham A., 1989).
Наиболее изученным проявлением влияния на кожу АКТГ и МСГ является стимуляция меланогенеза и переключение с феомеланогенеза на эумеланогенез, что подтверждается и клиническими наблюдениями. Исследования на клеточных культурах нормальных и злокачественных меланоцитов показали, что МСГ и АКТГ связываются с рецепторами и проявляют максимальную меланогенную активность (Slominski A., 2000). У людей значение пептидов-производных ПОМК в физиологической пигментации было продемонстрировано при изучении фенотипа детей с дефицитом ПОМК, которые всегда имеют рыжую окраску волос.
α-МСГ, АКТГ и рецепторы МК-1 являются ауто- и паракринными регуляторами пигментации не только кожи, но и волос (Slominski A., 2005). В настоящее время активно ведутся исследования по изучению возможности применения препаратов на основе α-МСГ для профилактики и лечения поседения волос. В этих целях предполагается использование синтетического аналога α-МСГ, который может имитировать функции естественного гормона и обладает минимумом побочных эффектов при клиническом применении. Его использование может быть особенно полезным в лечении поседения волос, поствоспалительном полиозе (рост седых волос в фазу регресса при очаговой алопеции).
Помимо регуляции пигментации, α-МСГ и АКТГ обладают и другими эффектами на волосяные фолликулы. АКТГ и α-МСГ экспрессируются клетками наружной оболочки волосяных фолликулов в фазе анагена, дермальными фибробластами и эндотелиоцитами капилляров. У мышей АКТГ действует как индуктор фазы роста, но провоцирует преждевременное начало катагена при воздействии на фолликулы волос в фазе анагена (Paus R., et al., 1994; 1999).
Рост волос и циклическая активность волосяного фолликула определяются «биологическими часами», которые у грызунов меняют физиологию и морфологию кожи. Наиболее низкая секреция β-эндорфина, АКТГ и α-МСГ наблюдается в фазу телогена, повышаясь во время анагена и снижаясь во время катагена (Ermak G., Slominski A., 1997). Из этого можно заключить, что биологические часы, регулирующие активность волосяных фолликулов, одновременно регулируют и местную продукцию, высвобождение нейрогормонов и экспрессию соответствующих рецепторов.
АКТГ является основным регулятором синтеза глюкокортикоидов. Функции этих гормонов разнообразны — от регуляции метаболизма до модификации иммунологического и воспалительного ответов. Наиболее биологически активным глюкокортикоидом, секретируемым надпочечниками, является кортизол (на его долю приходится 80%). Остальные 20% в порядке убывания активности составляют кортизон, кортикостерон, 11-дезоксикортизол и 11-дезоксикортикостерон.
В сутки надпочечниками секретируется 15–30 мг кортизола. Более 90% кортизола циркулирует в крови в комплексе с белками — преимущественно с глобулином (кортикоидсвязывающим глобулином или транскортином). Незначительная часть связана с альбуминами. На долю свободной фракции приходится примерно 8% кортизола плазмы, и именно свободный кортизол и отвечает за биологический эффект. Дефицит инсулина и эстрогенов повышает содержание транскортина, что приводит к повышению общей концентрации связанного кортизола. Заболевания печени и почек, а также длительный прием глюкокортикоидов сопровождаются снижением содержания транскортина и уменьшением фракции кортизола, связанного с этим белком, на фоне этого появляются клинические признаки избытка глюкокортикоидов.
При длительном применении глюкокортикоиды ингибируют синтетическую активность фибробластов и остеобластов, в результате развиваются истончение кожи и остеопороз. Применение глюкокортикоидов поддерживает катаболизм мышц, что чревато развитием их атрофии и мышечной слабости.
Для синтеза и секреции кортиколиберина, АКТГ и кортизола характерна выраженная суточная периодичность (т.н. циркадианный ритм). Увеличение секреции кортизола наступает после засыпания и достигает максимума при пробуждении. Уровень кортизола исследуется между 6 и 8 ч утра, поскольку именно этот уровень отражает пик активности гипоталамо-гипофизарно-надпочечниковой системы. Как первичная, так и вторичная надпочечниковая недостаточность (при этих состояниях одним из многочисленных симптомов является выпадение волос) проявляются снижением содержания кортизола в крови, но часто содержание кортизола в плазме крови в утренние часы имеет нормальные или пограничные значения, что требует дальнейшего обследования.
Необходимо иметь в виду, что ряд препаратов глюкокортикоидов, в частности гидрокортизон (кортизол), кортизон и метилпреднизолон могут давать перекрестную реакцию с эндогенным кортизолом, что требует их отмены как минимум за 24 ч до исследования. Дексаметазон такой перекрестной реакции не дает, однако необходимо помнить, что он является наиболее мощным ингибитором секреции АКТГ гипофизом.
2.5. Инсулин и инсулиноподобные факторы роста
Инсулин — гормон пептидной природы, образуется в бета-клетках островков Лангерганса поджелудочной железы. Основное действие инсулина заключается в снижении концентрации глюкозы в крови. Инсулин увеличивает проницаемость плазматических мембран для глюкозы, активирует ключевые ферменты гликолиза, стимулирует образование в печени и мышцах из глюкозы гликогена, усиливает синтез жиров и белков.
Кроме того, инсулин подавляет активность ферментов, расщепляющих гликоген и жиры. То есть, помимо анаболического действия, инсулин обладает также и антикатаболическим эффектом. Нарушение секреции инсулина вследствие деструкции бета-клеток — абсолютная недостаточность инсулина — является ключевым звеном патогенеза сахарного диабета 1-го типа. Нарушение действия инсулина на ткани — относительная инсулиновая недостаточность — имеет важное место в развитии сахарного диабета 2-го типа.
В исследовании Philpott M.P. с соавт. (1994) показано, что инсулин является стимулятором роста волос in vitro в диапазоне концентраций 0,01–100 мкг/мл. Максимальные темпы роста волосяного фолликула наблюдались при концентрации инсулина 10 мкг/мл. Волосяные фолликулы в отсутствие инсулина или при его физиологических уровнях преждевременно входили в фазу катагена. Инсулиноподобные факторы роста IGF-I и IGF-II не производили значимого эффекта на рост волосяного фолликула в присутствии 10 мкг/мл инсулина. Однако картина менялась, если инсулин отсутствовал, — в этом случае IGF-I и IGF-II стимулировали рост волосяного фолликула. При этом IGF-I становится даже более мощным фактором роста, чем сам инсулин.
В клинической практике стоит обратить внимание на связь андрогенетической алопеции с метаболическим синдромом, ключевую роль в развитии которого имеет избыточная секреция инсулина на фоне низкой чувствительности клеток к этому гормону. Впервые этот синдром описал американский ученый Джеральд Ривен. В конце 1980-х гг. Ривен обосновал существование синдрома резистентности к инсулину, определяющего сопутствующее развитие артериальной гипертензии, сахарного диабета 2-го типа, дислипидемии и атеросклероза.
В 2003 г. опубликованы данные популяционного исследования, проведенного финскими исследователями: женщины с алопецией 2–3-й стадии по Людвигу достоверно чаще имели признаки инсулинорезистентности (висцеральное ожирение, уровень инсулина свыше 10 mU/l, микроальбуминурия) в сравнении с контрольной группой. Сделан вывод, что женщины с маркерами инсулинорезистентности подвержены значимым рискам развития алопеции (Matilainen V., et al., 2003).
Спустя 3 года работа была продолжена, на этот раз в исследовании участвовало 245 мужчин в возрасте 63 года. Анализ данных показал, что достоверно чаще облысение имели мужчины, у которых диагностирована артериальная гипертензия. Гиперинсулинемия и инсулинорезистентность диагностированы у 61% мужчин с андрогенетической алопецией против 49% без алопеции.
Еще более убедительные данные показаны в исследовании Ahouansou S.A. с соавт. (2007), выявившем аналогичную взаимосвязь, — 82% мужчин с артериальной гипертензией имели облысение, в то время как в группе с нормальным артериальным давлением алопеция отмечалась у 56%.
Достоверная корреляция между андрогенетической алопецией у женщин и наличием коронарной патологии, часто развивающейся на фоне инсулинорезистентности, показана в исследовании Mansouri P. с соавт. (2005).
Была отмечена связь между повышенной активностью 5α-редуктазы и резистентностью к инсулину как у мужчин, так и у женщин (Tomlinson J.W., et al., 2008).
Хорошо известно, что у женщин инсулинорезистентность имеет выраженную ассоциацию с синдромом поликистозных яичников (наиболее частая причина функциональной гиперандрогении у женщин), при котором, помимо системной гиперандрогении, ановуляции, метаболических нарушений, отмечается избыточная активность 5α-редуктазы и, как правило, присутствует андрогенная алопеция, акне и гирсутизм (рис. I-2-3) (Burghen G.A., et al., 1980; Dunaif A., Hoffman A.R., 1988; Tsilchorozidou H., et al., 2002).
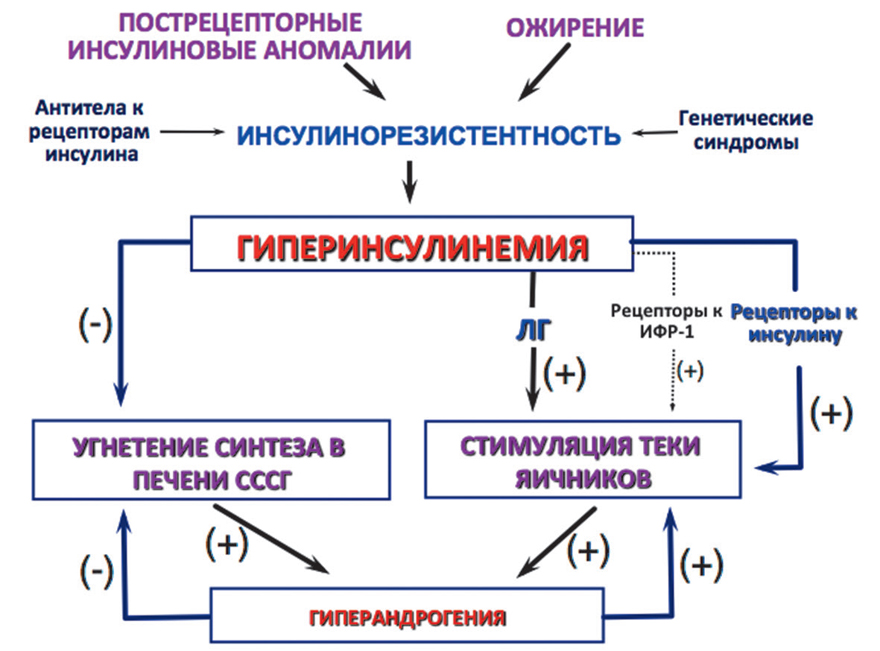
Рис. I-2-3. Связь инсулинорезистентности и гиперандрогении2.6. Витамин D
В последнее десятилетие интерес к витамину D значительно вырос. По своей химической структуре, особенностям взаимодействия с ядерными рецепторами и по многочисленным функциям витамин D относится, скорее, к стероидным гормонам, чем к «классическим» витаминам.
Помимо хорошо известной роли в обмене кальция, витамин D является регулятором иммунных реакций, роста и дифференцировки клеток. Активная форма витамина D — 1,25-дигидроксивитамин D3 (1,25(ОН)2 D3) — выполняет свои функции после связывания со специфичными рецепторами VDR, которые расположены в ядрах клеток-мишеней и входят в суперсемейство кортикоидных рецепторов. Таким образом, витамин D регулирует экспрессию генов путем связывания со специфическими элементами гормонального ответа. Экспрессия VDR в кератиноцитах необходима для регуляции цикла волосяных фолликулов. Дефицит витамина D приводит к нарушению эпидермальной дифференцировки и регуляции роста волос (Xie Z., et al., 2002).
В работе Kong J. и соавт. (2002) показано, что в результате инактивации рецепторов VDR у человека и мышей развивается алопеция. Современные данные позволяют сделать заключение о том, что рецепторы витамина D необходимы для адекватного функционирования волосяных фолликулов.
У пациентов с наследственным резистентным к 1,25(ОН)2D3 рахитом II типа изменения в фенотипе включают алопецию (Sakai Y., et al., 2001).
Относительно недавно были описаны иммуномодулирующие свойства витамина D. Этот витамин взаимодействует с моноцитами, макрофагами, дендритными клетками, с Т- и В- лимфоцитами, оказывая влияние как на врожденный, так и на приобретенный иммунитет. Кроме того, иммунные клетки выделяют ферменты, которые позволяют осуществлять локальный синтез активной формы витамина D из предшественников. Снижение содержания витамина D в организме приводит к повышению риска инфекционных и аутоиммунных заболеваний: туберкулез, системная красная волчанка, ревматоидный артрит, диабет, рассеянный склероз.
Известно, что гнездная алопеция является аутоиммунным заболеванием, связанным с наличием воспаления в зоне волосяных фолликулов. В перекрестном исследовании Aksu Ceman A. с соавт. (2014) участвовало 86 пациентов с гнездной алопецией, 44 пациента с витилиго и 58 здоровых участников контрольной группы. Уровень 1,25(ОН)2D3 оценивался методом жидкостной хроматографии/масс спектрометрии. Дефицит витамина D в группе с гнездной алопецией определялся у 91% и коррелировал с тяжестью заболевания, в группе с витилиго — 71%, в группе контроля 33% имели дефицит этого гормона.
В клиническом примере, приводимом в статье «Успешное лечение гнездной алопеции с применением топического кальципотриола» (Dong H.K., et al., 2012), авторы обнаружили снижение экспрессии VDR, которое удалось преодолеть путем наружного назначения аналога витамина D — кальципотриола.
Таким образом, современные представления свидетельствуют о том, что гормон D может быть фактором защиты для ряда аутоиммунных заболеваний, в том числе гнездной алопеции.
Согласно собственным данным, среди пациентов – жителей Москвы, обращающихся к дерматологу-трихологу в период с октября по май, 75% имеют уровень витамина D в сыворотке крови в диапазоне 10–20 нг/мл (оптимальная концентрация — 50–100 нг/мл).
2.7. Пептиды тимуса
Вилочковая железа (тимус) является жизненно важным органом иммунной системы. Основными функциями тимуса являются обеспечение положительной и отрицательной селекции иммунокомпетентных клеток, регуляция роста, созревания и дифференцировки Т-лимфоцитов, а также активности зрелых клеток иммунной системы. Выполнение функций тимуса реализуется благодаря особому строению железы и опосредуется секретируемыми гормонами: гомеостатическим гормоном тимуса-α, гомеостатическим гормоном тимуса-β, протимозином-α, тимопоэтином II, тимозином-β4, гуморальным фактором тимуса, тимозином-α1, тимозином-α7, тимулином, тимопентина пентапептидом.
Первым свидетельством тесной онтогенетической связи тимуса (вилочковой железы) и волосяных фолликулов можно считать врожденное отсутствие тимуса у мутантных голых мышей (Hsd:Athymic Nude-Foxn1nu), выведенных С.П. Фланаганом в 1966 г. В последующем оказалось, что фактор транскрипции FOXN1 экспрессируется исключительно в эпителии тимуса и коже не только у мышей, но и у человека. Мутации в этом гене приводят к врожденному отсутствию волос и ранней гибели по причине инфекционных заболеваний на фоне отсутствия тимуса и у животных, и у человека.
О влиянии тимуса на функционирование волосяных фолликулов также свидетельствует сообщение Dasgupta и коллег, проанализировавших массу тимуса и длину волос на теле у 105 погибших от несчастных случаев и показавших, что иммуногенный статус тимуса может оцениваться по длине волос на теле, поскольку при большей массе тимуса длина волос была больше.
Следует отметить, что в волосяном фолликуле человека выявлена экспрессия таких пептидов тимуса, как тимулин, тимозин-β4 и протимозин-α. При этом локализация этих пептидов приурочена к активно пролиферирующим структурам волосяного фолликула, что указывает на их участие в регуляции роста волоса. Meier N. и соавт. (2012) в контролируемом исследовании показали, что пептиды тимуса (тимозин-α1, тимулин и тимозин-β4) оказывают прямое влияние на рост волос человека при обработке органной культуры волосяных фолликулов in vitro. И хотя эффект пептидов тимуса в экспериментах указанных авторов был разнонаправленным и зависел от концентрации исследуемых белков (тимулин увеличивал скорость роста стержня волоса, а тимозин-α1 и тимозин-β4 уменьшали), опыт клинического применения пептидов тимуса при нерубцовых алопециях свидетельствует о способности тимозина-β4 (и, по-видимому, других пептидов тимуса) эффективно стимулировать рост волос.
Тимозин-β4 (Тβ4) — белок с молекулярной массой 4900 Да, содержащий 43 аминокислоты. Тβ4 оказывает широкий спектр биологических эффектов: играет важную роль в подвижности клеток благодаря участию в быстрой полимеризации/деполимеризации актина и ускоряет репаративные процессы в коже, стимулирует ангиогенез, оказывает противовоспалительный и другие эффекты.
Влияние на функцию волосяных фолликулов этого пептида тимуса наиболее изучено. Суммируя известные на сегодняшний день факты, можно сказать, что Тβ4 оказывает положительное влияние на рост волос, одновременно воздействуя на ряд ключевых звеньев:
-
стволовые клетки в области bulge — стимулирует их миграцию и дифференциацию;
-
микроциркуляцию — благодаря ангиогенному действию улучшает питание клеток;
-
матриксные протеиназы — регулирует их экспрессию, способствуя ремоделированию дермального матрикса вокруг волосяного фолликула в процессе его развития;
-
иммуноциты — уменьшает воспаление, что особенно актуально при гнездной алопеции.
Тимулин (Тл) — это пептид из 9 аминокислот, который связывает ион цинка, необходимый для реализации биологических функций белка. Тимулин является короткоживущим белком, его концентрация в крови максимальна в ранний постнатальный период и с возрастом постепенно снижается. Для секреции Тл характерен циркадный ритм с пиком концентрации в ночное время.
Тимулин синтезируется эпителиальными клетками вилочковой железы и считается специфическим для этого органа белком, но иммуногистохимическими методами его экспрессия была выявлена в эпидермисе и придатках кожи, а также в печени мышей. Известно, что тимулин регулирует высвобождение гипофизом пролактина, тиреотропина и адренокортикотропного гормона, определяющих рост волос, циклическую смену фаз анагена, телогена и катагена, а также их пигментацию.
Интересно, что у больных гнездной алопецией уровень тимулина в плазме крови значительно снижен по сравнению со здоровыми людьми, что было показано в выборке из 77 больных по сравнению с 64 контрольными испытуемыми, соответствующими по полу и возрасту (p < 0,00001). При этом уровень тимулина не зависит от наличия циркулирующих органоспецифических антител к тимулину или наличия атопических заболеваний, но степень снижения уровня тимулина в сыворотке крови отчетливо коррелирует со степенью тяжести гнездной алопеции: при наличии отдельных очагов уровень снижен, при тотальной алопеции содержание тимулина еще ниже, а при универсальной алопеции тимулин часто не определяется.
Также оказалось, что уровень тимулина в сыворотке крови коррелирует и с активностью гнездной алопеции: при активном восстановлении роста волос больных младше 20 лет уровень тимулина ниже средних нормальных показателей в 50% случаев, при стабильном течении гнездной алопеции (отсутствие выпадения волос и восстановления их роста) — у 80% больных, а при активном выпадении волос — у 100% пациентов (p < 0,001).
Отличия также были статистически значимыми при сравнении больных с активным выпадением волос и больных с возобновлением их роста. У больных старше 20 лет не отмечалось значимых отличий между контрольной группой и больными с восстановлением роста волос; при стабильном течении у 78% пациентов уровень тимулина был ниже средних нормальных показателей; при активном выпадении — у 81% (p < 0,001). Таким образом, в клинических исследованиях показано, что чем выше активность заболевания, тем ниже уровень тимулина в плазме крови.
Эти наблюдения согласуются с клинической практикой восполнения дефицита цинка для стимуляции роста волос и ногтей: по-видимому, такой эффект может быть опосредован, в том числе тимулином, выполняющим свои биологические функции только при наличии иона цинка в активном центре.
2.8. Нейромедиаторы кожи
В норме эпителий волосяного фолликула характеризуется относительным иммуннопривилегированным статусом с очень низкой экспрессией антигенов главного комплекса гистосовместимости I и II классов и локальной продукцией мощных иммуносупрессоров (трансформирующего фактора роста-β1 и α-МСГ) (Paus R., et al. 2005). Перифолликулярные нервные волокна тесно контактируют с иммунными клетками (макрофагами, дендритными клетками, тучными клетками) (Peters E.M., et al., 2006). В то же время все больше данных свидетельствует о нейроиммуноэндокринной регуляции смены фаз в цикле развития волосяного фолликула.
Так, пептидергические нервные волокна, образуя тесные связи главным образом с тучными клетками (Botchkarev V.A., et al., 1995), регулируют их функцию посредством высвобождения таких нейромедиаторов, как вещество Р, пептид, связанный с геном кальцитонина (CGRP), альфа-меланоцит-стимулирующий гормон, кортикотропин-рилизинг-гормон и многих других. Интересно, что для этих взаимодействий характерны изменения, зависящие от смены фаз цикла развития волоса, что указывает на вовлеченность коммуникации нервных волокон и тучных клеток в регуляцию роста волоса.
Фактически, медиаторы тучных клеток могут как стимулировать наступление и прогрессирование фазы анагена, так и способствовать вступлению волосяного фолликула в фазу катагена (Maurer M., et al., 1995).
Считается, что высвобождение нейропептидов нервными волокнами оказывает провоспалительный эффект и приводит к дегрануляции тучных клеток с высвобождением гистамина, протеаз и нейропептидов, инициирующих развитие нейрогенного воспаления (Baluk P., 1997). Нейрогенное воспаление, регулируемое веществом Р и фактором роста нервов, зависит от нейроиммунных взаимодействий и способствует преждевременному прекращению роста волос (рис. I-2-4).
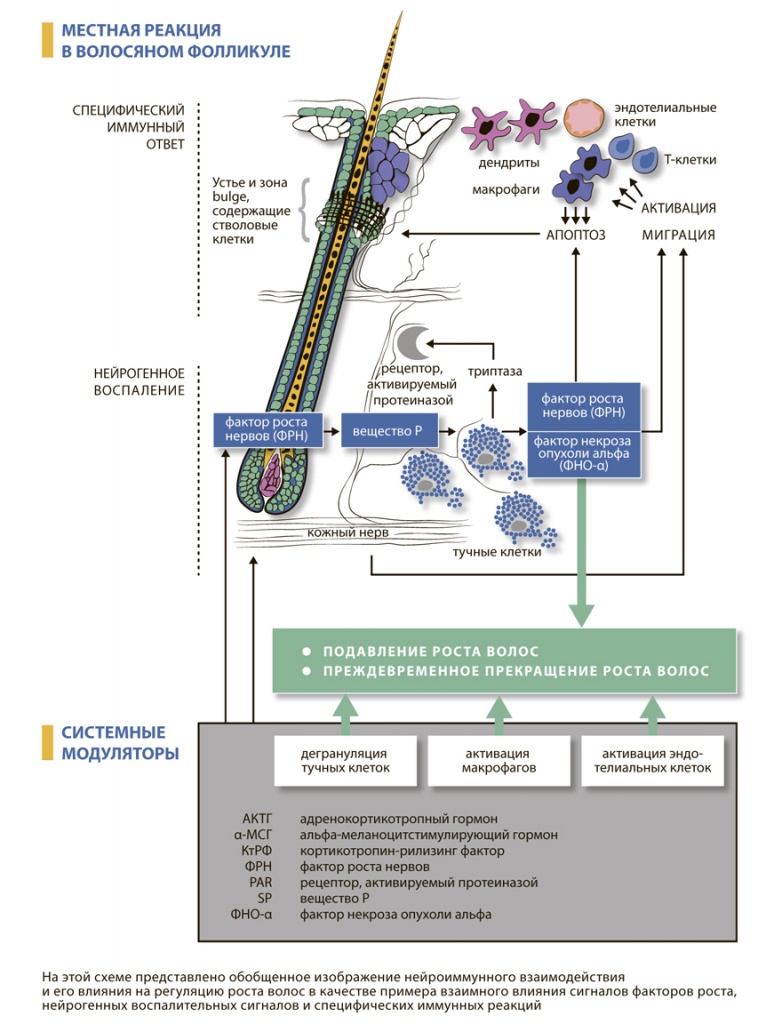
Рис. I-2-4. Нейроиммунная регуляция волосяных фолликуловЗнания в области эндокринологии необходимы врачу-трихологу, ведь волосяные фолликулы находятся на пересечении сложной нейроэндокринной и иммунной регуляции, обусловливающей как местное, так и системное влияние на организм многочисленных эндогенных и экзогенных факторов, генома и эпигенома.
Известная нам информация, вероятно, составляет лишь малую толику того, что принесут будущие открытия. Но даже то, что нам уже известно, сегодня позволяет более эффективно и предсказуемо лечить облысение и улучшать состояние волос.
Страница 1 - 8 из 8
Начало | Пред. | 1 | След. | Конец119334, Россия, Москва, м.Ленинский проспект, ул. Вавилова, д.4
Розничные продажи- 8 (999) 897-92-82
- order@tricholog.ru
Оптовые продажи, оборудование, cотрудничество- 8 (999) 897-92-91
- opt@tricholog.ru
Медицинский центр- 8 (999) 897-92-62
- info@tricholog.ru
Обучение- 8 (999) 897-92-91
- rudntricholog@mail.ru
- Медицинский центр



